Pathogenese der AAV
Die Entwicklung der AAV ist ein komplexer, multifaktorieller Autoimmunprozess2,3
Die eigentlichen Ursachen der AAV sind bislang noch unklar.2,3 Prädisponierende Faktoren wie mikrobielle Infektionen, genetische Einflüsse, Umweltbelastungen und bestimmte Medikamente und Rauschmittel haben einen wesentlichen Anteil an der Entwicklung einer AAV.2,3
Auch die Exposition gegenüber Siliziumdioxid, Pestiziden, Dämpfen, Baustoffen, Kohlenwasserstoffen (Reinigungsmittel, Farbe, Diesel), Medikamenten (Propylthiouracil, Hydralazin, D-Penicillamin, Cefotaxim, Minocyclin, Anti-TNF-Wirkstoffe, Phenytoin) und bestimmte psychotrope Substanzen können eine AAV hervorrufen.2,3
ANCA-Beteiligung
Verlust der Immuntoleranz gegenüber ANCA-Antigenen und Bildung von ANCA durch Plasmazellen1
ANCA zielen hauptsächlich auf die neutrophilen lysosomalen Enzyme PR3 bzw. MPO bei der GPA bzw. MPA ab1-5
Priming von Neutrophilen
Neutrophile werden durch proinflammatorische Zytokine (TNF-α, IL-1 und IL-18) als Reaktion auf eine Infektion oder ein anderes Ereignis geprimt, wobei auch die genetische Prädisposition relevant ist2,6,7
Präsentation von ANCA-Antigenen
Geprimte Neutrophile präsentieren ANCA-Antigene (z. B. MPO und PR3) auf der Zelloberfläche, die an ANCA binden und so die Aktivierung von Neutrophilen hervorrufen1,2,6,7
Freisetzung von Entzündungsmediatoren
Aktivierte Neutrophile haften an der Blutgefäßwand an, durchbrechen die Wand und setzen Entzündungs- und Zellverletzungsmediatoren frei, z. B. NETs1,2,6
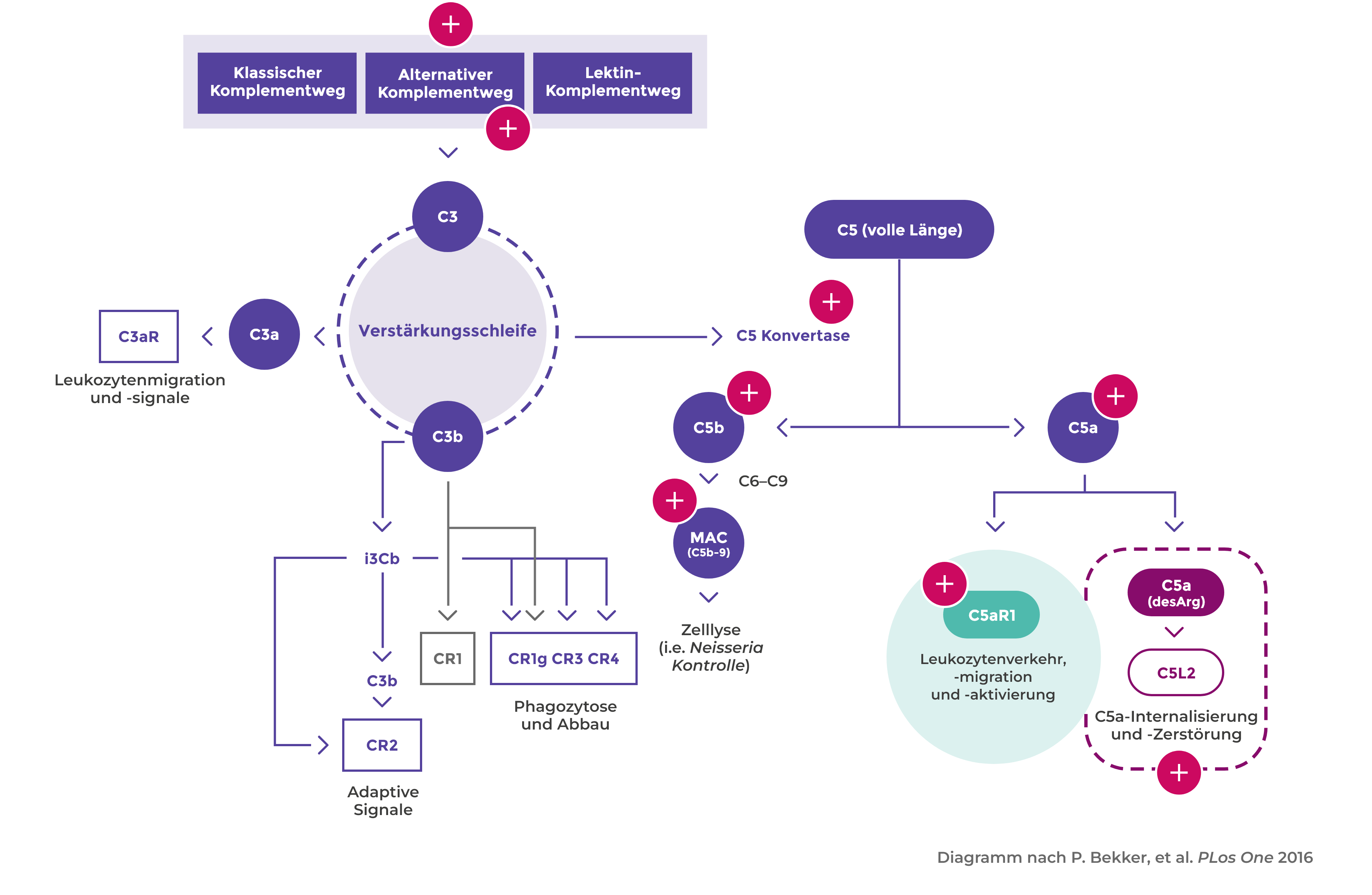
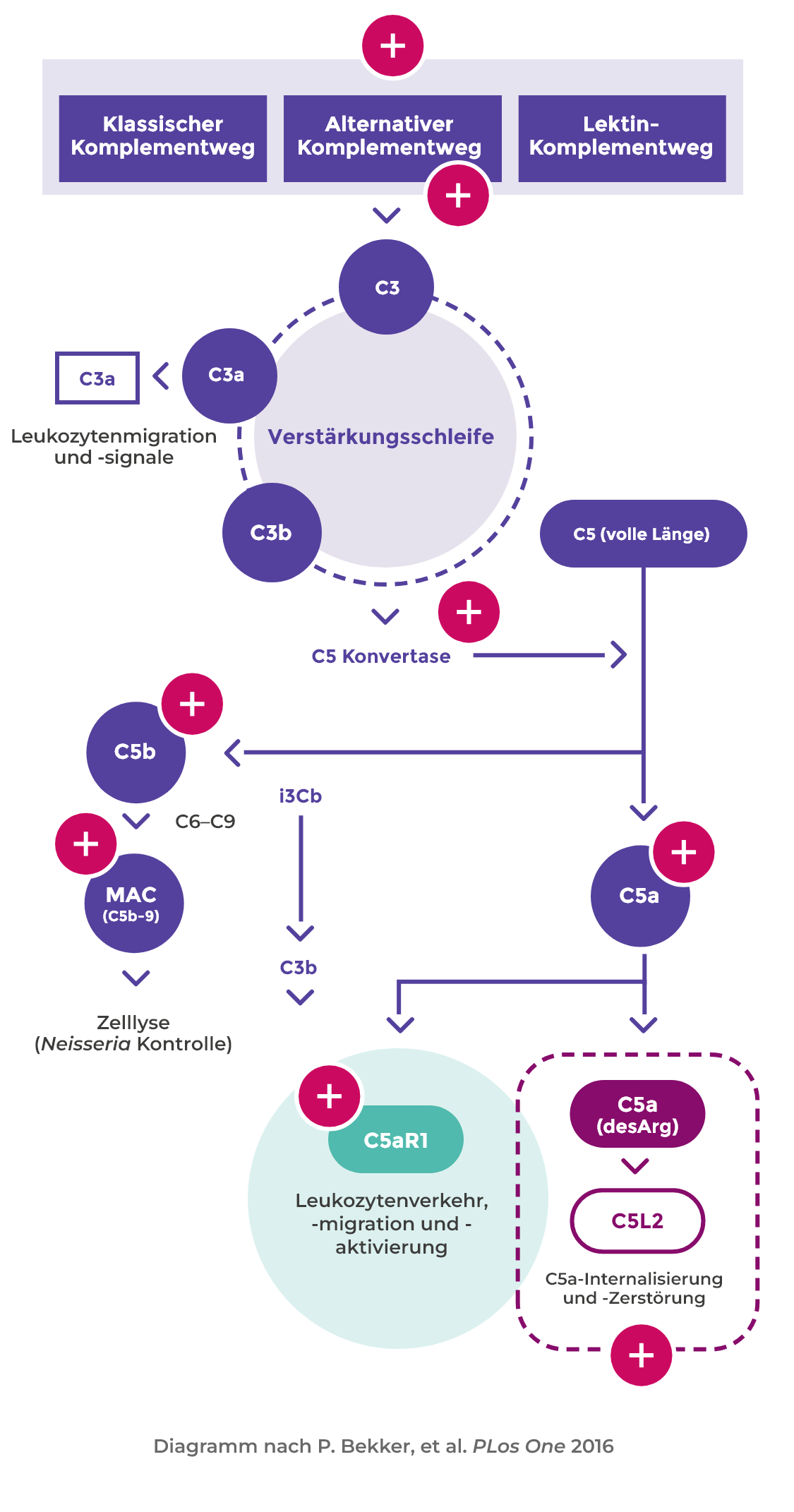
Aktivierung des alternativen Komplementwegs
Aktivierte Neutrophile setzen außerdem Faktoren wie Properdin frei, die autokrin auf die Aktivierung des alternativen Komplementwegs einwirken und damit die Bildung von C5a begünstigen1,6
Bindung von C5a an C5aR1
Die Bindung von C5a an C5aR1 verstärkt die ANCA-induzierte Entzündung und Gefäßschädigung6
Nekrotisierende Vaskulitis
Dieser Prozess führt zu einer nekrotisierenden Vaskulitis der kleinen Blutgefäße6
Chronische Entzündung
Im Lauf weniger Tage werden die akute Entzündung und die Nekrose durch eine chronische Entzündung und Narbenbildung abgelöst6
Stellenwert von Komplement und Neutrophilen bei der AAV-Aktivierung
C5a verstärkt die ANCA-induzierte Entzündung und Gefäßschädigung und hat somit einen erheblichen Anteil an der Pathogenese der AAV1

Einführung in die AAV
AAV ist eine seltene, schwer verlaufende Vaskulitis der kleinen Blutgefäße mit Beteiligung mehrerer Organe und hohem Mortalitätsrisiko1
Weiterlesen
Krankheitsmechanismus
Die Interaktion zwischen dem aktivierten alternativen Komplementweg, den Neutrophilen und C5a steht im Zentrum der
vaskulitisbedingten
Schädigung durch die AAV2
Behandlung der AAV
Ein praktischer Leitfaden für die Behandlung und das Krankheitsmanagement von AAV-Patient*innen
Mehr erfahren